Perifere sensitisatie
In reactie op weefselbeschadiging worden bepaalde substanties vrijgelaten; zij vormen de zogenaamde "inflammatory soup" in de periferie. Het gaat onder meer om peptiden (bradykinine), lipiden (prostaglandine), 5-HT, ribonucleotiden (adenosinetrifosfaat, ATP) en NGF (nerve growth factor), die de terminals van de nociceptoren sensitiseren- d.w.z, de drempelwaarde verlagen, door interactie met receptoren, ionkanalen en nociceptieve vezels (vrije uitlopers).
De theorie is dat prostaglandinen binden aan G-proteïne-gekoppelde receptoren, om daarmee het gehalte van AMP binnen de nociceptoren te verhogen. Bekend is dat prostaglandinen de drempelwaarde voor het genereren van de actiepotentiaal kunnen verlagen via het proces van fosforylering.
Activatie van de nociceptor initieert afferente transmissie richting de dorsale hoorn; door efferente transmissie vindt exocytose van substance P, calcitonin-gene-related-peptide (CGRP, verantwoordelijk voor vasodilatatie) vanuit Na-kanalen plaats. De efferente exocytose van substance P stimuleert neutrofiele granulocyten om histaminen aan de stimuli toe te voegen. De "inflammatory soup" bewerkstelligt de migratie van leukocyten.
Door Mercedes Bouter. Rechtvaardigheid en wetenschap boven alles. Je kunt bij mij terecht voor alfa, bèta, in het bijzonder alles over het vak GENBA3B1 (functies van de hersenen & neuroscience, mijn favoriete subjecten), geschiedenis, kunst, maatschappij en recht!
Posts tonen met het label hersenen. Alle posts tonen
Posts tonen met het label hersenen. Alle posts tonen
vrijdag 30 december 2016
donderdag 3 november 2016
Psychopathologie: (klinische) visies op schizofrenie (1)
Een eerste biologische benadering van schizofrenie..
Vroeger was de psychiatrisch patiënt veroordeeld tot een uitzichtloos bestaan in de dolhuyzen: bedrust was het devies- de aanpak bestond uit het vastsnoeren van de patiënt aan het bed, eventueel met een muilkorf, hoofdkap of zelfs kooi om de "dolle" patiënt te isoleren (Google maar eens op "Maasoord Krankzinnigeninstituut"- het is vreselijk om te zien hoe de psychiatrisch patiënt werd behandeld vanwege een gebrek aan wetenschappelijk inzicht).
Was de aandoening een teken van God, een zwakte in het karakter, had de dolle mens niet voldoende wilskracht om zich normaal te gedragen? Eind negentiende eeuw en begin twintigste eeuw werden dan eindelijk de fysiologische kenmerken geëxploreerd, na een vroege constatering dat syfilis ten grondslag zou liggen aan de ziekte. Een biologische benadering van schizofrenie was hoopgevend voor de gehospitaliseerde patiënt, die in de toekomst niet langer aan bed geketend zou zijn. Helaas moest nog een flinke horde worden genomen: in de jaren '50 en '60 won de lobotomie aan populariteit, met alle gevolgen van dien voor de psychiatrisch patiënt.
Relatief recentelijk (jaren '90) zijn er veel vindingen gedaan op het gebied van genetica.Waarom zo laat? Er was geen consensus over de weging van de genetische component. Er is een genetische component verbonden aan schizofrenie, maar epigenetica en andere factoren (extern milieu) zijn mede bepalend voor de expressie van de ziekte. Opvallend is de functioneel-anatomische component van schizofrenie: de hersenen van een schizofreen vertonen een ander beeld dan de hersenen van de gezonde referentiegroep, zoals zal worden besproken aan de hand van verschillende onderzoeksresultaten.
Symptoombeschrijving
De patiëntenpopulatie met schizofrenie vertoont onder meer de volgende kenmerken: zelfoverschatting, grootheidswaanzin, obsessief denken en bizar handelen (godsdienstwaanzin, paranoïde gedrag, ritueel handelen) paralytische dementie (zoek in de wetenschappelijke database op "frontotemporale dementie", M.B.), delusies, slecht beoordelingsvermogen, gebrek aan zelfevaluatie en excessieve/ abnormale myosis. Het klinisch-neurologisch beeld is dat de motorische coördinatie is geaffecteerd; bij schizofrene participanten wordt het gebrek aan soepel verlopende oogbewegingen geconstateerd (zie Torrey et al, 1994; bevestigend is het onderzoek van Avila et al, 2006).
De positieve symptomen, acquisitief, zijn aan de psychose gerelateerde verschijnselen: hallucinaties, delusies, desorganisatie in denken en spraak en het vertoon van bizar gedrag.
Negatieve symptomen duiden op het verlies van normale functies, of het gebrek daaraan, gelieerd aan de emotionele disregulatie (gebrek aan emotionele expressie, apathische gezichtsuitdrukking, anhedonia) en verminderde motivatie (alogia en avolitie, ziekte-inherent).
Epidemiologie
Verhoogd risico onder:
* migranten;
* stedelingen;
* cannabisgebruikers (correlatie DRD2 en AKT1, zie http://www.nature.com/articles/npjschz201525)
Predispositie: neurobiologische factoren
Erfelijkheid: 40-80% monozygote tweelingen, 17% broers/zussen, 17% dizygote tweelingen, 13% kinderen;
Genetische factoren neurale organisatie: DISC1, BDNF, AKT1, NRG1 (abnormaliteit dendronale ontwikkeling (spines));
Aanvang: adolescentie, correlatie met volgroeiing frontale cortex;
Cerebrale differentiatie
Verschil in structuur en functionaliteit corpus callosum;
Corticale abnormaliteit: verlies tot 4% per jaar van substantia grisea (MRI: zie vnl. temporaal, frontaal en pariëtaal) bij adolescenten;
Ventriculaire abnormaliteit, vergroting. Algehele hersenvolume niet geaffecteerd bij expressie van DISC1; ventriculi cerebri ten koste van cerebrum;
Reductie prefrontale synaptische densiteit;
Hypofrontaliteit: gereduceerde metabolische activiteit (evaluatie: Minzenberg, 2009)
Dopamine-hypothese
Suppressie van positieve symptomen door dopamine-antagonisten (chlorpromazine/ haloperidol, 1950). Blokkade van de D2-receptor. Toepassing van amfetaminen: vertoon van positieve symptomen bij accumulatie van dopamine in synaptische transmissie bevestigt dopamine-hypothese.
Contra-indicaties:
Tijdsspanne effect blokkade dopaminereceptoren (uren) en verdwijnen positieve symptomen (weken);
Atypische antipsychotica: clozapine blokkeert 5-HT25-receptoren. Typische en atypische antipsychotica zijn gelijkelijk effectief (vgl. Jones et al, 2006).
Toediening clozapine kan de exocytose van dopamine in de frontale cortex doen toenemen, waarbij de symptomen van schizofrenie juist worden gereduceerd;
Supplementair L-dopa: reductie symptomen schizofrenie.
Bronnen: "Mechanisms underlying psychosis and antipsychotic treatment response in schizophrenia" ( in vivo, blokkade striatale D2/D3-receptoren) & "Dopamine dynamics during {...} clozapine compared with haloperidol". Zoeken via Pubmed advanced, vrij downloaden voor studenten en medewerkers Erasmus MC via de medische bibliotheek.
Vroeger was de psychiatrisch patiënt veroordeeld tot een uitzichtloos bestaan in de dolhuyzen: bedrust was het devies- de aanpak bestond uit het vastsnoeren van de patiënt aan het bed, eventueel met een muilkorf, hoofdkap of zelfs kooi om de "dolle" patiënt te isoleren (Google maar eens op "Maasoord Krankzinnigeninstituut"- het is vreselijk om te zien hoe de psychiatrisch patiënt werd behandeld vanwege een gebrek aan wetenschappelijk inzicht).
Was de aandoening een teken van God, een zwakte in het karakter, had de dolle mens niet voldoende wilskracht om zich normaal te gedragen? Eind negentiende eeuw en begin twintigste eeuw werden dan eindelijk de fysiologische kenmerken geëxploreerd, na een vroege constatering dat syfilis ten grondslag zou liggen aan de ziekte. Een biologische benadering van schizofrenie was hoopgevend voor de gehospitaliseerde patiënt, die in de toekomst niet langer aan bed geketend zou zijn. Helaas moest nog een flinke horde worden genomen: in de jaren '50 en '60 won de lobotomie aan populariteit, met alle gevolgen van dien voor de psychiatrisch patiënt.
Relatief recentelijk (jaren '90) zijn er veel vindingen gedaan op het gebied van genetica.Waarom zo laat? Er was geen consensus over de weging van de genetische component. Er is een genetische component verbonden aan schizofrenie, maar epigenetica en andere factoren (extern milieu) zijn mede bepalend voor de expressie van de ziekte. Opvallend is de functioneel-anatomische component van schizofrenie: de hersenen van een schizofreen vertonen een ander beeld dan de hersenen van de gezonde referentiegroep, zoals zal worden besproken aan de hand van verschillende onderzoeksresultaten.
Symptoombeschrijving
De patiëntenpopulatie met schizofrenie vertoont onder meer de volgende kenmerken: zelfoverschatting, grootheidswaanzin, obsessief denken en bizar handelen (godsdienstwaanzin, paranoïde gedrag, ritueel handelen) paralytische dementie (zoek in de wetenschappelijke database op "frontotemporale dementie", M.B.), delusies, slecht beoordelingsvermogen, gebrek aan zelfevaluatie en excessieve/ abnormale myosis. Het klinisch-neurologisch beeld is dat de motorische coördinatie is geaffecteerd; bij schizofrene participanten wordt het gebrek aan soepel verlopende oogbewegingen geconstateerd (zie Torrey et al, 1994; bevestigend is het onderzoek van Avila et al, 2006).
De positieve symptomen, acquisitief, zijn aan de psychose gerelateerde verschijnselen: hallucinaties, delusies, desorganisatie in denken en spraak en het vertoon van bizar gedrag.
Negatieve symptomen duiden op het verlies van normale functies, of het gebrek daaraan, gelieerd aan de emotionele disregulatie (gebrek aan emotionele expressie, apathische gezichtsuitdrukking, anhedonia) en verminderde motivatie (alogia en avolitie, ziekte-inherent).
Epidemiologie
Verhoogd risico onder:
* migranten;
* stedelingen;
* cannabisgebruikers (correlatie DRD2 en AKT1, zie http://www.nature.com/articles/npjschz201525)
Predispositie: neurobiologische factoren
Erfelijkheid: 40-80% monozygote tweelingen, 17% broers/zussen, 17% dizygote tweelingen, 13% kinderen;
Genetische factoren neurale organisatie: DISC1, BDNF, AKT1, NRG1 (abnormaliteit dendronale ontwikkeling (spines));
Aanvang: adolescentie, correlatie met volgroeiing frontale cortex;
Cerebrale differentiatie
Verschil in structuur en functionaliteit corpus callosum;
Corticale abnormaliteit: verlies tot 4% per jaar van substantia grisea (MRI: zie vnl. temporaal, frontaal en pariëtaal) bij adolescenten;
Ventriculaire abnormaliteit, vergroting. Algehele hersenvolume niet geaffecteerd bij expressie van DISC1; ventriculi cerebri ten koste van cerebrum;
Reductie prefrontale synaptische densiteit;
Hypofrontaliteit: gereduceerde metabolische activiteit (evaluatie: Minzenberg, 2009)
Dopamine-hypothese
Suppressie van positieve symptomen door dopamine-antagonisten (chlorpromazine/ haloperidol, 1950). Blokkade van de D2-receptor. Toepassing van amfetaminen: vertoon van positieve symptomen bij accumulatie van dopamine in synaptische transmissie bevestigt dopamine-hypothese.
Contra-indicaties:
Tijdsspanne effect blokkade dopaminereceptoren (uren) en verdwijnen positieve symptomen (weken);
Atypische antipsychotica: clozapine blokkeert 5-HT25-receptoren. Typische en atypische antipsychotica zijn gelijkelijk effectief (vgl. Jones et al, 2006).
Toediening clozapine kan de exocytose van dopamine in de frontale cortex doen toenemen, waarbij de symptomen van schizofrenie juist worden gereduceerd;
Supplementair L-dopa: reductie symptomen schizofrenie.
Bronnen: "Mechanisms underlying psychosis and antipsychotic treatment response in schizophrenia" ( in vivo, blokkade striatale D2/D3-receptoren) & "Dopamine dynamics during {...} clozapine compared with haloperidol". Zoeken via Pubmed advanced, vrij downloaden voor studenten en medewerkers Erasmus MC via de medische bibliotheek.
Labels:
5-HT,
clozapine,
dopamine,
DSM V,
GENBA3B1,
geneeskunde,
haloperidol,
hersenen,
Mercedes Bouter neurowetenschappen,
psychiatrie,
psychopathologie,
Pubmed,
receptoren,
schizofrenie
vrijdag 21 oktober 2016
Nociceptie: tracti (discriminatief en affectief-motivationeel)
In de periferie eindigen de axonen van nociceptoren in vrije zenuwuiteinden- de niet-gespecialiseerde zenuwuiteinden in de huid. Er kan een grove indeling worden gemaakt naar gelang het type axon. Aδ-mechanosensitieve en mechanothermische axonen zijn gemyeliniseerd en conductie vindt plaats met een snelheid van 2 m/s; de conductie van ongemyeliniseerde C-axonen bedraagt minder dan 2 m/s. De C-axonen maken deel uit van de groep polymodale nociceptoren.
Over het algemeen geldt: de transmissie van nociceptie verloopt traag, anders dan de transmissie van somatosensibele informatie.
Stimulatie van het receptief veld, waarbij overschrijding van de drempelwaarde Aδ-vezels activeert, roept een primaire, scherpe pijn op ("first pain"); wordt de intensiteit van de stimulus versterkt, dan worden de C-vezels actief, waardoor een langdurige, zeurende pijn ("second pain") wordt opgeroepen.
Discriminatieve component. Noxius.
Tractus dorsolaterlis Lissauer (anterolateralis- tractus spinothalamicus)
De sensibel-discriminatieve component (locus, intensiteit en kwaliteit van de onaangename ("noxius"= noci = pijnlijke, gevaarlijke) stimulans) volgt de tractus lateralis, te beginnen in de ganglia van de dorsale wortel. Onthoud: L1- L5 ontvangt vitale informatie over het onderlichaam, C3- C7 ontvangt vitale informatie over het bovenlichaam, exclusief het gezicht. De nociceptoren hebben met overige sensibele neuronen gemeen, dat zij axonen via de dorsale hoorn projecteren. Voordat de substantia grisea van de dorsale hoorn door de axonen wordt bereikt, worden de collateralen van axonen over de loop van twee segmenten in dalende en stijgende banen verspreid (Lissauer). Binnen de substantia grisea van de dorsale hoorn, wordt contact gemaakt met de laminae van Rexed.
De axonen van deze neuronen van de tweede orde kruisen over de middellijn en worden in opstijgende banen, anterolateraal aan contralaterale zijde, via de tractus spinothalamicus, richting de hersenstam en de nucleus ventralis posterolateralis thalami geprojecteerd.
Karakteristiek voor vitale sensibiliteit en pijn is dat een laesie resulteert in een verlies van juiste sensatie aan contralaterale zijde onder het niveau van de laesie; de zenuwbanen kruisen immers al in de medulla spinalis, anders dan bij mechanosensibiliteit. De zenuwbanen voor de gnostische sensibiliteit stijgen ipsilateraal op en een laesie resulteert dan ook in uitval van sensatie aan dezelfde zijde onder het niveau van de laesie.
Affectief-motivationele component. Nuclei parabrachiales. Formatio reticularis.
De axonen van lamina I van de dorsale hoorn, worden via de tractus anterolateralis geprojecteerd richting de medulla (caudaal); vervolgens worden zij geprojecteerd naar de reticulaire formatie. De nuclei parabrachiales zijn gesitueerd op de kruising van de pons met mesencephalon reticulaire formatie, in de nabijheid van de pedunculus cerebellaris superior. De neuronen in de nuclei parabrachiales projecteren hun axonen richting hypothalamus en amygdala. Ook wordt er geprojecteerd richting PAG, substantia grisea centralis, voor de controle van activiteit in aflopende richting.
Projecties van lamina V naar nuclei intralaminares thalami.
De tractus anterolateralis projecteert naar de nuclei thalami, mediaal gelegen ten opzichte van de nucleus ventralis posterior thalami en de nuclei intralaminares thalami. Vanaf deze nuclei worden signalen afgegeven aan de frontaalkwab, de insula en de cortex cingularis.
Over het algemeen geldt: de transmissie van nociceptie verloopt traag, anders dan de transmissie van somatosensibele informatie.
Stimulatie van het receptief veld, waarbij overschrijding van de drempelwaarde Aδ-vezels activeert, roept een primaire, scherpe pijn op ("first pain"); wordt de intensiteit van de stimulus versterkt, dan worden de C-vezels actief, waardoor een langdurige, zeurende pijn ("second pain") wordt opgeroepen.
Discriminatieve component. Noxius.
Tractus dorsolaterlis Lissauer (anterolateralis- tractus spinothalamicus)
De sensibel-discriminatieve component (locus, intensiteit en kwaliteit van de onaangename ("noxius"= noci = pijnlijke, gevaarlijke) stimulans) volgt de tractus lateralis, te beginnen in de ganglia van de dorsale wortel. Onthoud: L1- L5 ontvangt vitale informatie over het onderlichaam, C3- C7 ontvangt vitale informatie over het bovenlichaam, exclusief het gezicht. De nociceptoren hebben met overige sensibele neuronen gemeen, dat zij axonen via de dorsale hoorn projecteren. Voordat de substantia grisea van de dorsale hoorn door de axonen wordt bereikt, worden de collateralen van axonen over de loop van twee segmenten in dalende en stijgende banen verspreid (Lissauer). Binnen de substantia grisea van de dorsale hoorn, wordt contact gemaakt met de laminae van Rexed.
De axonen van deze neuronen van de tweede orde kruisen over de middellijn en worden in opstijgende banen, anterolateraal aan contralaterale zijde, via de tractus spinothalamicus, richting de hersenstam en de nucleus ventralis posterolateralis thalami geprojecteerd.
Karakteristiek voor vitale sensibiliteit en pijn is dat een laesie resulteert in een verlies van juiste sensatie aan contralaterale zijde onder het niveau van de laesie; de zenuwbanen kruisen immers al in de medulla spinalis, anders dan bij mechanosensibiliteit. De zenuwbanen voor de gnostische sensibiliteit stijgen ipsilateraal op en een laesie resulteert dan ook in uitval van sensatie aan dezelfde zijde onder het niveau van de laesie.
Affectief-motivationele component. Nuclei parabrachiales. Formatio reticularis.
De axonen van lamina I van de dorsale hoorn, worden via de tractus anterolateralis geprojecteerd richting de medulla (caudaal); vervolgens worden zij geprojecteerd naar de reticulaire formatie. De nuclei parabrachiales zijn gesitueerd op de kruising van de pons met mesencephalon reticulaire formatie, in de nabijheid van de pedunculus cerebellaris superior. De neuronen in de nuclei parabrachiales projecteren hun axonen richting hypothalamus en amygdala. Ook wordt er geprojecteerd richting PAG, substantia grisea centralis, voor de controle van activiteit in aflopende richting.
Projecties van lamina V naar nuclei intralaminares thalami.
De tractus anterolateralis projecteert naar de nuclei thalami, mediaal gelegen ten opzichte van de nucleus ventralis posterior thalami en de nuclei intralaminares thalami. Vanaf deze nuclei worden signalen afgegeven aan de frontaalkwab, de insula en de cortex cingularis.
zondag 16 oktober 2016
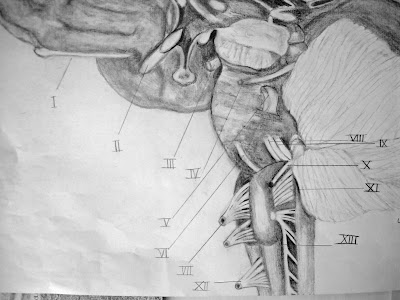
Sagittale coupe: craniale zenuwen
I Nervus olfactorius
II Nervus opticus
III Nervus oculomotorius
IV Nervus trochlearis
V Nervus trigeminus
VI Nervus abducens
VII Nervus hypoglossus
VIII Nervus facialis
IX Nervus vestibulocochlearis
X Nervus glossopharyngeus
XI Nervus vagus
XII Nervus cervicalis 1
XIII Nervus accessorius
Labels:
brain,
C1,
cranialis,
drawing,
geneeskunde,
glossopharyngeus,
hersenen,
Mercedes Bouter neurowetenschappen,
nervus,
neuroscience,
olfactorius,
opticus,
pituitary,
tekeningen,
vagus,
vestibulocochlearis
vrijdag 14 oktober 2016
Long Term Potentiation uitgelegd: synaptische plasticiteit
LTP in de hippocampale formatie
Sterke depolarisatie in de postsynaptische membraan is het sleutelbegrip. Neem de Schaffercollateralen als uitgangspunt. LTP treedt slechts op indien de postsynaptische cel sterk gedepolariseerd raakt en indien de activiteiten in de pre- en postsynaptische cel vrijwel simultaan plaatsvinden (de depolarisatie van de postsynaptische cel geschiedt binnen 100 ms ná de exocytose). LTP regardeert alleen de actieve synapsen van het betreffende neuron. Door dit mechanisme wordt informatie selectief opgeslagen. Welk proces in CA1 heeft meer effect: sterke, specifieke stimulatie met LTP van één actieve synaps (site 1) tot gevolg, of sterke stimulatie van site 1 en zwakke, maar wel simultane stimulatie van site 2? De tweede optie: de associativiteit van site 1 en 2 impliceert versterking van LTP.
AMPA en NMDA
Gedurende de rustpotentiaal is het NMDA-kanaal in de postsynaptische membraan, geblokkeerd door Mg2+. Dit magnesiumblok verhindert de influx van Ca2+-ionen. De excitatoire transmitter glutamaat bindt aan NMDA- en AMPA-receptoren. Het geblokkeerde NMDA-kanaal is voltage-gated; sterke depolarisatie brengt veranderingen in de synaps teweeg (zie eerder bericht: actiepotentiaal en synaptische transmissie). Sterke stimulatie en daarmee een in duur toegenomen depolarisatie bewerktstelligt de verwijdering van het magnesiumblok uit het NMDA-kanaal.
De influx van calciumionen in het NMDA-kanaal en daarmee een toename van de concentratie van positief geladen Ca2+-ionen in de dendrieten van het postsynaptisch neuron, leidt tot LTP. Twee processen zijn noodzakelijk voor LTP: duidelijk is dat het NMDA-kanaal slecht geopend kan worden indien glutamaat aan de ligand bindt en indien simultaan (binnen het tijdsbestek van 100 ms) depolarisatie in het postsynaptisch neuron optreedt.
Terug naar site 1 en 2. Site 1 wordt sterk gestimuleerd. De zwakke stimulatie van site 2 is voldoende voor een exocytose van glutamaat, maar het Mg2+-blok zal niet uit het NMDA-kanaal gedreven worden. De simultane, krachtige stimulatie van site 1 zorgt echter wel voor de nodige depolarisatie.
Second messengers
Een logisch gevolg is dat synaptische transmissie wordt bevorderd door de influx van Ca2+ in de postsynaptische cel, via geactiveerde NMDA-kanalen. Calciumionen worden aangetrokken door de "second messengers" CaMKII (Ca2+ calmoduline kinase) en proteïne kinase C (PKC). De bevordering van LTP heeft retrograde transmissie (dus richting de site van de synaptische transmissie) tot effect. De synaptische plasticiteit (uitdrukking van LTP) wordt duidelijk, als blijkt dat nieuwe AMPA-receptoren in de postsynaptische membraan worden geïnstalleerd. De additieve AMPA-receptoren zouden synaptische transmissie versterken voor de duur van de LTP.
Sterke depolarisatie in de postsynaptische membraan is het sleutelbegrip. Neem de Schaffercollateralen als uitgangspunt. LTP treedt slechts op indien de postsynaptische cel sterk gedepolariseerd raakt en indien de activiteiten in de pre- en postsynaptische cel vrijwel simultaan plaatsvinden (de depolarisatie van de postsynaptische cel geschiedt binnen 100 ms ná de exocytose). LTP regardeert alleen de actieve synapsen van het betreffende neuron. Door dit mechanisme wordt informatie selectief opgeslagen. Welk proces in CA1 heeft meer effect: sterke, specifieke stimulatie met LTP van één actieve synaps (site 1) tot gevolg, of sterke stimulatie van site 1 en zwakke, maar wel simultane stimulatie van site 2? De tweede optie: de associativiteit van site 1 en 2 impliceert versterking van LTP.
AMPA en NMDA
Gedurende de rustpotentiaal is het NMDA-kanaal in de postsynaptische membraan, geblokkeerd door Mg2+. Dit magnesiumblok verhindert de influx van Ca2+-ionen. De excitatoire transmitter glutamaat bindt aan NMDA- en AMPA-receptoren. Het geblokkeerde NMDA-kanaal is voltage-gated; sterke depolarisatie brengt veranderingen in de synaps teweeg (zie eerder bericht: actiepotentiaal en synaptische transmissie). Sterke stimulatie en daarmee een in duur toegenomen depolarisatie bewerktstelligt de verwijdering van het magnesiumblok uit het NMDA-kanaal.
De influx van calciumionen in het NMDA-kanaal en daarmee een toename van de concentratie van positief geladen Ca2+-ionen in de dendrieten van het postsynaptisch neuron, leidt tot LTP. Twee processen zijn noodzakelijk voor LTP: duidelijk is dat het NMDA-kanaal slecht geopend kan worden indien glutamaat aan de ligand bindt en indien simultaan (binnen het tijdsbestek van 100 ms) depolarisatie in het postsynaptisch neuron optreedt.
Terug naar site 1 en 2. Site 1 wordt sterk gestimuleerd. De zwakke stimulatie van site 2 is voldoende voor een exocytose van glutamaat, maar het Mg2+-blok zal niet uit het NMDA-kanaal gedreven worden. De simultane, krachtige stimulatie van site 1 zorgt echter wel voor de nodige depolarisatie.
Second messengers
Een logisch gevolg is dat synaptische transmissie wordt bevorderd door de influx van Ca2+ in de postsynaptische cel, via geactiveerde NMDA-kanalen. Calciumionen worden aangetrokken door de "second messengers" CaMKII (Ca2+ calmoduline kinase) en proteïne kinase C (PKC). De bevordering van LTP heeft retrograde transmissie (dus richting de site van de synaptische transmissie) tot effect. De synaptische plasticiteit (uitdrukking van LTP) wordt duidelijk, als blijkt dat nieuwe AMPA-receptoren in de postsynaptische membraan worden geïnstalleerd. De additieve AMPA-receptoren zouden synaptische transmissie versterken voor de duur van de LTP.
Labels:
AMPA,
CA1,
formatie,
GENBA3B1,
geneeskunde,
hersenen,
hippocampus,
LTP,
Mercedes Bouter,
Mercedes Bouter geneeskunde,
neurofysiologie,
neuron,
neurowetenschappen,
NMDA
maandag 10 oktober 2016
Elektrofysiologie: membraanpotentiaal
De rustpotentiaal van de membraan van het neuron is gewoonlijk negatief en bedraagt tussen de -40 en -90 mV; ga uit van een gemiddelde van -65 milliVolt.
Twee procesmatige regels liggen ten grondslag aan het genereren van een elektrische potentialen over de membranen van neuronen:
1. De concentratie van bepaalde ionen binnen en buiten de membraan verschilt;
2. Membranen zijn selectief permeabel voor specifieke ionen.
Ionen kunnen niet tegen de concentratiegradiënt in bewegen; daartoe bestemde eiwitten in de membraan, de zogeheten "iontransporters", worden geactiveerd om de ionen tegen de concentratiegradiënt in, de membraan te laten passeren. Het ion bindt aan de iontransporter, waarop de iontransporter "omklapt" om het ion tegen de gradiënt in te bewegen. De iontransporter creëert hierbij een concentratiegradiënt.
Ionkanalen zijn selectief permeabel. De concentratiegradiënt die is gegenereerd door de iontransporter, maakt diffusie van ionen via de ionkanalen mogelijk (in- of efflux). De wisselwerking tussen de iontransporter en het ionkanaal houdt de membraanpotentiaal in evenwicht.
Het cytoplasma buiten de membraan is negatief geladen, het plasma binnen de membraan is positief geladen door de aanwezigheid van K-ionen. De K-ionen vloeien af door diffusie; er ontstaat een spanningsverschil doordat het cytoplasma binnen de membraan meer negatief geladen raakt: gebruik voor het spanningsverschil de formule [K+]2/[K+]1 (Wet van Nernst).
Logischerwijs wordt een evenwicht bereikt tussen en vanwege twee elektrochemische mechanismen:
1. De concentratiegradiënt buiten het cytoplasma van de membraan trekt positief geladen kaliumionen aan (elektrostatische druk, zie rustpotentiaal en actiepotentiaal);
2. De elektrische gradiënt buiten de celmembraan trekt de kaliumionen niet langer aan.
Waarom wordt geen significant potentiaalverschil teweeggebracht? Onthoud dat de concentratie kaliumionen binnen en buiten de membraan in evenwicht wordt gehouden door de aanwezigheid van negatief geladen chlorideionen. Gebruik in de berekening van de potentiaal een tienvoud (Log [K+]2/[K+]1) om betrouwbare waarden te verkrijgen.
Twee procesmatige regels liggen ten grondslag aan het genereren van een elektrische potentialen over de membranen van neuronen:
1. De concentratie van bepaalde ionen binnen en buiten de membraan verschilt;
2. Membranen zijn selectief permeabel voor specifieke ionen.
Ionen kunnen niet tegen de concentratiegradiënt in bewegen; daartoe bestemde eiwitten in de membraan, de zogeheten "iontransporters", worden geactiveerd om de ionen tegen de concentratiegradiënt in, de membraan te laten passeren. Het ion bindt aan de iontransporter, waarop de iontransporter "omklapt" om het ion tegen de gradiënt in te bewegen. De iontransporter creëert hierbij een concentratiegradiënt.
Ionkanalen zijn selectief permeabel. De concentratiegradiënt die is gegenereerd door de iontransporter, maakt diffusie van ionen via de ionkanalen mogelijk (in- of efflux). De wisselwerking tussen de iontransporter en het ionkanaal houdt de membraanpotentiaal in evenwicht.
Het cytoplasma buiten de membraan is negatief geladen, het plasma binnen de membraan is positief geladen door de aanwezigheid van K-ionen. De K-ionen vloeien af door diffusie; er ontstaat een spanningsverschil doordat het cytoplasma binnen de membraan meer negatief geladen raakt: gebruik voor het spanningsverschil de formule [K+]2/[K+]1 (Wet van Nernst).
Logischerwijs wordt een evenwicht bereikt tussen en vanwege twee elektrochemische mechanismen:
1. De concentratiegradiënt buiten het cytoplasma van de membraan trekt positief geladen kaliumionen aan (elektrostatische druk, zie rustpotentiaal en actiepotentiaal);
2. De elektrische gradiënt buiten de celmembraan trekt de kaliumionen niet langer aan.
Waarom wordt geen significant potentiaalverschil teweeggebracht? Onthoud dat de concentratie kaliumionen binnen en buiten de membraan in evenwicht wordt gehouden door de aanwezigheid van negatief geladen chlorideionen. Gebruik in de berekening van de potentiaal een tienvoud (Log [K+]2/[K+]1) om betrouwbare waarden te verkrijgen.
donderdag 29 september 2016
Anatomie van de hersenen: horizontale en sagittale sectie (practicumtekeningen)
 |
| Corpus callosum, rechter hemisfeer |
 |
| Horizontale sectie van de hersenen, ter hoogte van de fissura lateralis |
II nucleus caudatus (kop)
III nucleus lentiformis
IV putamen
V globus pallidus
VI thalamus opticus
VII lichaam caudatus nucleus
VIII insula
IX ventrikel
 |
| Hersenen: coupe sagittaal |
II Interventriculair foramen
III Septum pellucidum
IV Corpus callosum, truncus
V Plexus choroideus ventriculus
VI Splenium
VII Thalamus
VIII Glandula pinealis
IX Commissura post.
X Aqueductus mesencephali
XI Corpus mamillare
XII Glandula pituitaria (hypophysis)
XIII Chiasma nervorum opticorum
maandag 26 september 2016
Zenuwbanen, een introductie
Onderscheiden worden de opstijgende zenuwbanen, die somatosensibele impulsen geleiden naar de hersenen; afdalende zenuwbanen geleiden motorische impulsen van de hersenen naar voornamelijk de spieren en klieren in het lichaam.
De motorische (afdalende) zenuwbanen worden weer onderverdeeld in:
1.Het piramidale systeem, bestaande uit de tractus corticospinalis, of de tractus corticonuclearis, zenuwbanen die lopen van de cortex naar de motorische nuclei van de hersenzenuwen. De tractus corticospinalis loopt van de motorische cortex, door de capsula interna, vanuit het cerebrum naar het diencephalon, via de onderzijde van het mesencephalon, waar de zenuwbanen de crura cerebri vormen; "piramidebaan" duidt op de verschijning van de tractus in de medulla oblongata. In de medulla vindt de kruising plaats, waarna de piramidebanen in het ruggenmerg lateraal naar de ventrale hoorn van het juiste segment lopen. Merk op dat het voorname gedeelte van de tractus corticospinalis de tractus corticospinalis lateralis vormt en dat een minderheid ongekruist via de tractus corticospinalis anterior verloopt;
2. Het extrapiramidale systeem. Van de voorhoofdskwab lopen de zenuwvezels naar het corpus striatum, vervolgens van de nuclei in het mesencephalon (de nucleus ruber, nucleus niger, subthalamische nucleus), naar de oliva en formatio reticularis in de medulla oblongata. De tractus reticulospinalis verloopt lateraal naar de ventrale hoorn (= anterior).
De opstijgende (somatosensibele) zenuwbanen worden onderverdeeld in:
1. De tractus spinothalamicus, via de tractus spinothalamicus lateralis (pijn en temperatuur) of de tractus spinothalamicus anterior (grove tast en druk). Beide tracti komen samen in de spinale lemniscus;
2. Zenuwbanen naar de nucleus posterolateralis in het diencephalon, verlopend via de dorsale wortel. Impulsen afkomstig van de tractus gracilis (segmenten inferieur aan T6) worden geleid door de fasciculus gracilis; impulsen afkomstig van de tractus cuneatus (segmenten superieur aan T6) worden geleid door de fasciculus cuneatus;
3. De tractus spinocerebellaris wordt verdeeld in de tractus spinocerebellaris anterior en de tractus spinocerebellaris posterior (dorsale wortel).
De motorische (afdalende) zenuwbanen worden weer onderverdeeld in:
1.Het piramidale systeem, bestaande uit de tractus corticospinalis, of de tractus corticonuclearis, zenuwbanen die lopen van de cortex naar de motorische nuclei van de hersenzenuwen. De tractus corticospinalis loopt van de motorische cortex, door de capsula interna, vanuit het cerebrum naar het diencephalon, via de onderzijde van het mesencephalon, waar de zenuwbanen de crura cerebri vormen; "piramidebaan" duidt op de verschijning van de tractus in de medulla oblongata. In de medulla vindt de kruising plaats, waarna de piramidebanen in het ruggenmerg lateraal naar de ventrale hoorn van het juiste segment lopen. Merk op dat het voorname gedeelte van de tractus corticospinalis de tractus corticospinalis lateralis vormt en dat een minderheid ongekruist via de tractus corticospinalis anterior verloopt;
2. Het extrapiramidale systeem. Van de voorhoofdskwab lopen de zenuwvezels naar het corpus striatum, vervolgens van de nuclei in het mesencephalon (de nucleus ruber, nucleus niger, subthalamische nucleus), naar de oliva en formatio reticularis in de medulla oblongata. De tractus reticulospinalis verloopt lateraal naar de ventrale hoorn (= anterior).
De opstijgende (somatosensibele) zenuwbanen worden onderverdeeld in:
1. De tractus spinothalamicus, via de tractus spinothalamicus lateralis (pijn en temperatuur) of de tractus spinothalamicus anterior (grove tast en druk). Beide tracti komen samen in de spinale lemniscus;
2. Zenuwbanen naar de nucleus posterolateralis in het diencephalon, verlopend via de dorsale wortel. Impulsen afkomstig van de tractus gracilis (segmenten inferieur aan T6) worden geleid door de fasciculus gracilis; impulsen afkomstig van de tractus cuneatus (segmenten superieur aan T6) worden geleid door de fasciculus cuneatus;
3. De tractus spinocerebellaris wordt verdeeld in de tractus spinocerebellaris anterior en de tractus spinocerebellaris posterior (dorsale wortel).
vrijdag 23 september 2016
An introduction to the sensorimotor system
Introduction
Contrast sensory and motor tracts. Information travels to the brain via ascending tracts. Ascending tracts within the CNS are (somato)sensory. Descending motor tracts transmit information from the brain to the periphery.
Involved in the major sensory tracts (posterior column, spinothalamic (sensory, from spinal cord to thalamus) and spinocerebellar (from cord to cerebellum) are three divisions of neuronal systems:
Neurons of the 1st order transmit sensory information to the CNS via dorsal or cranial (root) ganglion;
Neurons of the 2nd order act on soma in CNS;
Neurons of the 3rd order transmit information from the thalamus to the cerebral cortex.
Gnostic sensibility pathways
As for gnostic sensibility (fine touch, vibration and proprioception), sensory projections enter the spinal cord via dorsal root ganglion cells. The axon transmits information via the posterior column of white matter, ascending to the brain. A first synapse is made in the caudal medullary gracile nucleus (all levels inferior to the sixth thoracic vertebra, T6) or cuneate nucleus (levels superior to T6); the medullary axon crosses the medial lemniscus, up to the ventral posterior nuclei in thalamus, where it ascends to the somatosensory cortex.
Take notice of the medial-lateral rule: information stemming from mechanosensory receptors from the lower body, entering the lumbar spinal cord, is transmitted through medial pathways within the spinal cord (that is, before the medullary crossover); mechanosensory receptors from the upper body, entering the cervical spinal cord, transmit information via lateral pathways in the spinal cord.
Vital sensibility pathways
Vital sensibility sums up nociception, temperature and crude touch sensations. Pain and temperature sensations, however, travel through antolateral or spinothalamic tracts (tractus spinothalamicus lateralis). Pain ( Aδ fibers, myelinated, fast conducting, or C fibers, unmyelinated slowly conducting) fibers and temperature afferent fibers send their axons to the dorsal root ganglia to enter the posterior gray horn (1st order); these axons synapse onto spinal neurons (this is the crossover site, 2nd order), to project across the medial line, entering the lateral spinothalamic tract, ascending via the ventral posterolateral thalamic nuclei (3rd order), up to S1, on the side opposite to the receptive field.
Within the anterior spinothalamic tracts, nerve fibers conducting information on crude touch and pressure, send their axons to enter the dorsal root ganglia, in order to enter the posterior gray horn (1st order); the second-order site of neuronal cell bodies is the posterior gray horn, but in contrast to the lateral spinothalamic tract as described above, the axons enter the anterior spinothalamic tract on the opposite, that is, the second order is a ventral pathway up to the ventral posterolateral thalamic nuceli (3rd order). Like the antolateral tract, the destination is S1, opposite to the receptive field.
Contrast sensory and motor tracts. Information travels to the brain via ascending tracts. Ascending tracts within the CNS are (somato)sensory. Descending motor tracts transmit information from the brain to the periphery.
Involved in the major sensory tracts (posterior column, spinothalamic (sensory, from spinal cord to thalamus) and spinocerebellar (from cord to cerebellum) are three divisions of neuronal systems:
Neurons of the 1st order transmit sensory information to the CNS via dorsal or cranial (root) ganglion;
Neurons of the 2nd order act on soma in CNS;
Neurons of the 3rd order transmit information from the thalamus to the cerebral cortex.
Gnostic sensibility pathways
As for gnostic sensibility (fine touch, vibration and proprioception), sensory projections enter the spinal cord via dorsal root ganglion cells. The axon transmits information via the posterior column of white matter, ascending to the brain. A first synapse is made in the caudal medullary gracile nucleus (all levels inferior to the sixth thoracic vertebra, T6) or cuneate nucleus (levels superior to T6); the medullary axon crosses the medial lemniscus, up to the ventral posterior nuclei in thalamus, where it ascends to the somatosensory cortex.
Take notice of the medial-lateral rule: information stemming from mechanosensory receptors from the lower body, entering the lumbar spinal cord, is transmitted through medial pathways within the spinal cord (that is, before the medullary crossover); mechanosensory receptors from the upper body, entering the cervical spinal cord, transmit information via lateral pathways in the spinal cord.
Vital sensibility pathways
Vital sensibility sums up nociception, temperature and crude touch sensations. Pain and temperature sensations, however, travel through antolateral or spinothalamic tracts (tractus spinothalamicus lateralis). Pain ( Aδ fibers, myelinated, fast conducting, or C fibers, unmyelinated slowly conducting) fibers and temperature afferent fibers send their axons to the dorsal root ganglia to enter the posterior gray horn (1st order); these axons synapse onto spinal neurons (this is the crossover site, 2nd order), to project across the medial line, entering the lateral spinothalamic tract, ascending via the ventral posterolateral thalamic nuclei (3rd order), up to S1, on the side opposite to the receptive field.
Within the anterior spinothalamic tracts, nerve fibers conducting information on crude touch and pressure, send their axons to enter the dorsal root ganglia, in order to enter the posterior gray horn (1st order); the second-order site of neuronal cell bodies is the posterior gray horn, but in contrast to the lateral spinothalamic tract as described above, the axons enter the anterior spinothalamic tract on the opposite, that is, the second order is a ventral pathway up to the ventral posterolateral thalamic nuceli (3rd order). Like the antolateral tract, the destination is S1, opposite to the receptive field.
maandag 12 september 2016
Actiepotentiaal en synaptische transmissie
Vanaf de axon hillock verspreidt de elektrische activiteit zich over de segmenten van het axon, waarbij binnen de membraan van ieder volgend segment depolarisatie optreedt. Direct ontstaat een nieuwe actiepotentiaal, aangedreven door depolarisatie. Dezelfde waarde wordt over de gehele lengte van het axon gegenereerd door de instroom van natriumionen binnen de membraan van het segment. Bij een gemyeliniseerd axon verspreidt de elektrische lading zich sneller over de gehele lengte. In de jaren '80 werd het vermoeden uitgesproken dat de actiepotentiaal over zou "springen" naar de insnoeringen van Ranvier; inmiddels kan dit worden bevestigd. Dat verklaart waarom het proces bij een ongemyeliniseerd axon trager verloopt: in dat geval moeten over de gehele lengte natriumkanalen worden geopend om op geringe afstanden herhaaldelijk actiepotentialen te bewerkstelligen.
Synaptische transmissie (neuronaal)
De neuronale transmissie verschilt van de hiervoor geschetste axonale elektrische conductie. Typerend voor de neuronale transmissie is de gewogen postsynapstische potentiaal, waar de actiepotentiaal bij de axonale conductie slechts tot stand kan komen volgens de"alles-of-niets-wet". Axonale conductie is een proces van actieve verspreiding (zie hierboven), terwijl neuronale transmissie bestaat uit plaatselijke, passieve verspreiding van potentialen.
Maak een onderscheid tussen EPSP en IPSP. Excitatoire postsynaptische transmissie, EPSP, effectueert depolarisatie; bij de depolarisatie zijn natrium- en kaliumkanalen betrokken (positieve lading). Inhibitoire postsynaptische transmissie, IPSP, heeft hyperpolarisatie tot effect; bij deze hyperpolarisatie zijn chloride- en kaliumkanalen betrokken (negatieve lading). De postsynaptische receptoren bepalen de aard van de uitwerking- EPSP of IPSP. Zo kan acetylcholine, ACh, zowel inhibitoir als excitatoir werken: in het eerste geval is er een influx van Cl- en in het tweede geval een influx van Na+/ K+. De in de hersenen algemeen voorkomende excitatoire transmitter is glutamaat en GABA werkt inhibitoir (vgl. de werking van de kniereflex irl tot de periferie).
Synthese: het proces van de transmissie
De actiepotentiaal arriveert in de axon terminal van het presynaptisch neuron (1). In de presynaptische axon terminal neemt de instroom van positief geladen calciumionen toe (2). De energie zet vesiculi ertoe aan om neurotransmitter vrij te laten in de synaptische spleet (3). De stoffen die nodig zijn voor synthese, worden met regelmaat aangemaakt in het soma. Transmitterstoffen veranderen de membraanpotentiaal van de postsynaptische cel- deze effecten worden aangeduid als postsynaptische potentialen. De transmitter (ligand) bindt zich aan receptoren in de postsynaptische membraan; ionkanalen in de postsynaptische membraan openen zich en de elektrische transmissie creëert een excitatoire of inhibitoire potentiaal. De postsynaptische receptor bepaalt of de transmitter excitatoir of inhibitoir werkt (4). Postsynaptische potentialen verspreiden zich passief van de dendrieten en het soma tot de axon hillock (afferent).
Zie illustratie. Linksboven: myeline omhult het axon. De actiepotentiaal arrriveert bij de axon terminal. Vanuit het soma worden vesiculi en transmitterstoffen richting axon terminal gestuurd. Calciumionen stromen ionkanalen binnen. De vesiculi fuseren met de presynaptische membraan en er vindt exocytose plaats. De transporters zorgen voor de concentratie van ionen. Bindt de neurotransmitter aan de ligand-gated ion channel receptor (of de G-proteïne-gekoppelde receptor), dan opent de receptor in de postsynaptische membraan zich, om ionen in te laten stromen.
Synaptische transmissie (neuronaal)
De neuronale transmissie verschilt van de hiervoor geschetste axonale elektrische conductie. Typerend voor de neuronale transmissie is de gewogen postsynapstische potentiaal, waar de actiepotentiaal bij de axonale conductie slechts tot stand kan komen volgens de"alles-of-niets-wet". Axonale conductie is een proces van actieve verspreiding (zie hierboven), terwijl neuronale transmissie bestaat uit plaatselijke, passieve verspreiding van potentialen.
Maak een onderscheid tussen EPSP en IPSP. Excitatoire postsynaptische transmissie, EPSP, effectueert depolarisatie; bij de depolarisatie zijn natrium- en kaliumkanalen betrokken (positieve lading). Inhibitoire postsynaptische transmissie, IPSP, heeft hyperpolarisatie tot effect; bij deze hyperpolarisatie zijn chloride- en kaliumkanalen betrokken (negatieve lading). De postsynaptische receptoren bepalen de aard van de uitwerking- EPSP of IPSP. Zo kan acetylcholine, ACh, zowel inhibitoir als excitatoir werken: in het eerste geval is er een influx van Cl- en in het tweede geval een influx van Na+/ K+. De in de hersenen algemeen voorkomende excitatoire transmitter is glutamaat en GABA werkt inhibitoir (vgl. de werking van de kniereflex irl tot de periferie).
Synthese: het proces van de transmissie
De actiepotentiaal arriveert in de axon terminal van het presynaptisch neuron (1). In de presynaptische axon terminal neemt de instroom van positief geladen calciumionen toe (2). De energie zet vesiculi ertoe aan om neurotransmitter vrij te laten in de synaptische spleet (3). De stoffen die nodig zijn voor synthese, worden met regelmaat aangemaakt in het soma. Transmitterstoffen veranderen de membraanpotentiaal van de postsynaptische cel- deze effecten worden aangeduid als postsynaptische potentialen. De transmitter (ligand) bindt zich aan receptoren in de postsynaptische membraan; ionkanalen in de postsynaptische membraan openen zich en de elektrische transmissie creëert een excitatoire of inhibitoire potentiaal. De postsynaptische receptor bepaalt of de transmitter excitatoir of inhibitoir werkt (4). Postsynaptische potentialen verspreiden zich passief van de dendrieten en het soma tot de axon hillock (afferent).
Zie illustratie. Linksboven: myeline omhult het axon. De actiepotentiaal arrriveert bij de axon terminal. Vanuit het soma worden vesiculi en transmitterstoffen richting axon terminal gestuurd. Calciumionen stromen ionkanalen binnen. De vesiculi fuseren met de presynaptische membraan en er vindt exocytose plaats. De transporters zorgen voor de concentratie van ionen. Bindt de neurotransmitter aan de ligand-gated ion channel receptor (of de G-proteïne-gekoppelde receptor), dan opent de receptor in de postsynaptische membraan zich, om ionen in te laten stromen.
Labels:
ACh,
actiepotentiaal,
EPSP,
excitatoire,
GABA,
GENBA3B1,
geneeskunde,
hersenen,
inhibitoire,
IPSP,
Mercedes Bouter neurowetenschappen,
neuron,
neurotransmitter,
postsynaptisch,
synaps,
transmissie
donderdag 1 september 2016
Anatomie van de hersenen
Let niet op mijn "tekenkwaliteiten". Voordat het practicum klinische obductie (GEN2KV, kijk op blackboard bij geneeskunde) begint, een voorlopige schets van de anatomie van de hersengebieden en primaire functies.
Aan de bovenzijde van de cortex (vanuit lateraal perspectief) liggen achtereenvolgens de gyrus precentralis, de sulcus centralis en de gyrus postcentralis. De sulcus centralis "verdeelt" het cerebrum in de motorische cortex en de primaire sensibele cortex. Boven de lobus temporalis ligt de fissura lateralis (sulcus lateralis of fissura Sylvii).
De mesencephalon, pons en medulla oblongata geven impulsen tussen ruggenmerg en hersenen door; de hersenstam is verantwoordelijk voor basale functies als de ademhaling, hartslag, defecatie, emesis en slikken. Het cerebellum is van belang voor evenwicht en motoriek.
Kloksgewijs kunnen de functies als volgt in kaart worden gebracht:
Geel = cortex praefrontalis = gedrag, persoonlijkheid, integratie aangeleerde aspecten;
Donkergroen = centrum v. Broca, motorisch spraakcentrum (lokalisatie: gyrus frontalis inferior, lobus frontalis-linkerzijde);
Paars = premotorische cortex = coördinatie; gezamenlijk met nuclei basales/ ganglia coördineren van complexe bewegingen;
Azuur = motorische cortex;
Roze = primaire sensibele cortex;
Zonnegeel = sensibele associatiecortex;
Rood = visuele associatiecortex;
Zwart = primaire visuele cortex;
Appeltjesgroen = gehoorsassociatiecortex;
(met de winding mee)
Turkoois = primaire gehoorscortex;
Oker = centrum v. Wernicke, sensorisch spraakcentrum (lokalisatie: gelegen in temporalis, grens met parietalis).
De organisatie van de hersenen, van neurale buis tot volwassen brein, kan als volgt worden weergegeven:
 |
| Divisions of Central Nervous System: brain |
zondag 14 augustus 2016
De psychiatrische stoornissen: status mentalis en afweermechanismen
Status mentalis
De onderzoeksmethoden (anamnese, exploratie en observatie) worden gecombineerd om een zo volledig mogelijk beeld van de ziekte van de patiënt vast te stellen; vanouds wordt een driedeling gemaakt in cognitief-intellectuele functies, affectieve functies en conatieve functies (Trias psychica).
Kanttekening. De DSM V dient als hulpmiddel ter classificatie van de psychiatrische ziekte. Let wel, de DSM gaat uit van prototypen. Hoe adequaat zijn diagnoses over het algemeen? De zorgverzekeraar heeft in onze huidige maatschappij flinke invloed op het handelen van geneeskundigen. Artsen zien zich gedwongen om in een eerste gesprek met de patiënt al tot een (voorlopige) diagnose te komen. Het zal niet in alle gevallen al in het eerste gesprek duidelijk zijn welke psychiatrische diagnose op de patiënt van toepassing is- of dat er zelfs in het geheel geen sprake is van een psychiatrische aandoening. Ik heb tijdens mijn werk in een psychiatrisch ziekenhuis van artsen vernomen dat zij bij onduidelijkheid onder meer kiezen voor de diagnose "Angststoornis NAO", omdat deze diagnose vrij "neutraal" voorkomt: voor meerdere toepassing vatbaar.
Daarmee is niet gezegd dat de DSM geen goed hulpmiddel zou zijn bij het stellen van een diagnose. De DSM heeft gezorgd voor een systematische indeling van de stoornissen op grond van objectieve kenmerken, waarbij het aanbrengen van nuances goed mogelijk is.
Systematiek diagnose en classificatie
De systematiek van diagnose en classificatie in de psychiatrie, bestaat uit symptomen (1), syndroomdiagnose (2), structuurdiagnose (3) en classificatie (4).
Hiërarchie psychiatrische syndromen
De syndromen worden als volgt gerangschikt:
1. Cognitieve stoornissen (organisch);
2. Psychotische stoornissen (psychotisch);
3. Affectstoornissen (psychotisch-neurotisch);
4. Angst en dwang (neurotisch);
5. Stress- en aanpassingsstoornissen (neurotisch);
6. Somatoforme stoornissen (neurotisch);
7. Conatieve stoornissen (neurotisch);
8. Persoonlijkheids- en ontwikkelingsstoornissen (psychotisch-neurotisch).
Structuurdiagnose
In de fase van de structuurdiagnose, wordt op grond van neurobiologische en psychosociale factoren, de causaliteit van de psychiatrische ziekte onderzocht, waarbij een onderscheid wordt gemaakt tussen:
1. Predisponerende factoren;
2. Luxerende factoren;
3. Onderhoudende factoren.
De afweermechanismen van de psychiatrisch patiënt
Om het psychiatrisch lijden aan te kunnen of om psychiatrische problematiek tegenover de buitenwereld te ontkennen, maken psychiatrisch patiënten veelal gebruik van afweermechanismen. De patiënt kan pogen om de arts te misleiden door de ernst van de stoornis te bagatelliseren en het dagelijks leven en de omgang met andere mensen positiever voor te stellen dan in de praktijk het geval is; het vergt een kundig psychiater om daar doorheen te prikken.
Algemeen erkende psychische afweermechanismen zijn:
1. Psychotische afweermechanismen (immature afweermechanismen)
1. Projectie van wanen op situaties of op andere personen. Eigen psychiatrische kenmerken worden toegeschreven aan een andere persoon. Het gebruik van dit mechanisme is problematisch voor de leefomgeving en de directe sociale kring van de psychiatrisch patiënt, omdat de patiënt intensieve "haatcampagnes" kan voeren tegen een willekeurig doelwit;
2.Ontkenning van het psychisch lijden;
2. Isolatie van het affect;
3. Altruïsme. Een gedeelte van de patiëntenpopulatie neigt er sterk naar te handelen uit zogenaamde "naastenliefde", terwijl er in werkelijkheid puur vanuit de eigen problematiek wordt gehandeld. De patiënt vereenzelvigt zich met de doelgroep waarvoor hij zich inzet of hij heeft behoefte aan erkenning en waardering;
4. Fantasie. Bij pseudologia fantastica is de leugenaar (pseudoloog) zich bewust van de onwaarheden die hij of zij verspreidt. Een net van verzinselen wordt ingezet om de werkelijkheid te verdoezelen. Het immature afweermechanisme van de fantasie komt vaak mede tot uiting in sterke religieuze overtuigingen;
5. Introjectie en identificatie. De psychiatrisch patiënt identificeert zich met personen om de eigen onvermogens te compenseren. Andere personen kunnen worden gemobiliseerd, omdat de psychiatrisch patiënt de eigen ziektesymptomen in de ander herkent;
6. Idealisering. Aan andere personen worden overdreven positieve eigenschappen toegeschreven, personen of situaties kunnen worden verheerlijkt;
7. Ongedaanmaking. Religieuze rituelen, zoals boetedoening, kunnen worden ingezet als methode om het psychisch lijden te ontkennen;
8. Loochening;
9. Dissociëren;
10. Verschuiving. Er wordt een onderwerp gekozen om de psychiatrische problematiek te "verplaatsen". Zie de samenhang met projectie.
Let erop dat afweermechanismen op zichzelf nooit een diagnose op kunnen leveren, maar dat typische afweermechanismen wel degelijk indicatief kunnen zijn voor de onderliggende psychiatrische aandoening. De fase van de structuurdiagnose leent zich uiteraard voor een uitgebreid onderzoek naar het causaal verband tussen diverse factoren en de status mentalis.
De onderzoeksmethoden (anamnese, exploratie en observatie) worden gecombineerd om een zo volledig mogelijk beeld van de ziekte van de patiënt vast te stellen; vanouds wordt een driedeling gemaakt in cognitief-intellectuele functies, affectieve functies en conatieve functies (Trias psychica).
Kanttekening. De DSM V dient als hulpmiddel ter classificatie van de psychiatrische ziekte. Let wel, de DSM gaat uit van prototypen. Hoe adequaat zijn diagnoses over het algemeen? De zorgverzekeraar heeft in onze huidige maatschappij flinke invloed op het handelen van geneeskundigen. Artsen zien zich gedwongen om in een eerste gesprek met de patiënt al tot een (voorlopige) diagnose te komen. Het zal niet in alle gevallen al in het eerste gesprek duidelijk zijn welke psychiatrische diagnose op de patiënt van toepassing is- of dat er zelfs in het geheel geen sprake is van een psychiatrische aandoening. Ik heb tijdens mijn werk in een psychiatrisch ziekenhuis van artsen vernomen dat zij bij onduidelijkheid onder meer kiezen voor de diagnose "Angststoornis NAO", omdat deze diagnose vrij "neutraal" voorkomt: voor meerdere toepassing vatbaar.
Daarmee is niet gezegd dat de DSM geen goed hulpmiddel zou zijn bij het stellen van een diagnose. De DSM heeft gezorgd voor een systematische indeling van de stoornissen op grond van objectieve kenmerken, waarbij het aanbrengen van nuances goed mogelijk is.
Systematiek diagnose en classificatie
De systematiek van diagnose en classificatie in de psychiatrie, bestaat uit symptomen (1), syndroomdiagnose (2), structuurdiagnose (3) en classificatie (4).
Hiërarchie psychiatrische syndromen
De syndromen worden als volgt gerangschikt:
1. Cognitieve stoornissen (organisch);
2. Psychotische stoornissen (psychotisch);
3. Affectstoornissen (psychotisch-neurotisch);
4. Angst en dwang (neurotisch);
5. Stress- en aanpassingsstoornissen (neurotisch);
6. Somatoforme stoornissen (neurotisch);
7. Conatieve stoornissen (neurotisch);
8. Persoonlijkheids- en ontwikkelingsstoornissen (psychotisch-neurotisch).
Structuurdiagnose
In de fase van de structuurdiagnose, wordt op grond van neurobiologische en psychosociale factoren, de causaliteit van de psychiatrische ziekte onderzocht, waarbij een onderscheid wordt gemaakt tussen:
1. Predisponerende factoren;
2. Luxerende factoren;
3. Onderhoudende factoren.
De afweermechanismen van de psychiatrisch patiënt
Om het psychiatrisch lijden aan te kunnen of om psychiatrische problematiek tegenover de buitenwereld te ontkennen, maken psychiatrisch patiënten veelal gebruik van afweermechanismen. De patiënt kan pogen om de arts te misleiden door de ernst van de stoornis te bagatelliseren en het dagelijks leven en de omgang met andere mensen positiever voor te stellen dan in de praktijk het geval is; het vergt een kundig psychiater om daar doorheen te prikken.
Algemeen erkende psychische afweermechanismen zijn:
1. Psychotische afweermechanismen (immature afweermechanismen)
1. Projectie van wanen op situaties of op andere personen. Eigen psychiatrische kenmerken worden toegeschreven aan een andere persoon. Het gebruik van dit mechanisme is problematisch voor de leefomgeving en de directe sociale kring van de psychiatrisch patiënt, omdat de patiënt intensieve "haatcampagnes" kan voeren tegen een willekeurig doelwit;
2.Ontkenning van het psychisch lijden;
2. Isolatie van het affect;
3. Altruïsme. Een gedeelte van de patiëntenpopulatie neigt er sterk naar te handelen uit zogenaamde "naastenliefde", terwijl er in werkelijkheid puur vanuit de eigen problematiek wordt gehandeld. De patiënt vereenzelvigt zich met de doelgroep waarvoor hij zich inzet of hij heeft behoefte aan erkenning en waardering;
4. Fantasie. Bij pseudologia fantastica is de leugenaar (pseudoloog) zich bewust van de onwaarheden die hij of zij verspreidt. Een net van verzinselen wordt ingezet om de werkelijkheid te verdoezelen. Het immature afweermechanisme van de fantasie komt vaak mede tot uiting in sterke religieuze overtuigingen;
5. Introjectie en identificatie. De psychiatrisch patiënt identificeert zich met personen om de eigen onvermogens te compenseren. Andere personen kunnen worden gemobiliseerd, omdat de psychiatrisch patiënt de eigen ziektesymptomen in de ander herkent;
6. Idealisering. Aan andere personen worden overdreven positieve eigenschappen toegeschreven, personen of situaties kunnen worden verheerlijkt;
7. Ongedaanmaking. Religieuze rituelen, zoals boetedoening, kunnen worden ingezet als methode om het psychisch lijden te ontkennen;
8. Loochening;
9. Dissociëren;
10. Verschuiving. Er wordt een onderwerp gekozen om de psychiatrische problematiek te "verplaatsen". Zie de samenhang met projectie.
Let erop dat afweermechanismen op zichzelf nooit een diagnose op kunnen leveren, maar dat typische afweermechanismen wel degelijk indicatief kunnen zijn voor de onderliggende psychiatrische aandoening. De fase van de structuurdiagnose leent zich uiteraard voor een uitgebreid onderzoek naar het causaal verband tussen diverse factoren en de status mentalis.
Abonneren op:
Posts (Atom)